Ossidoriduzione, l’incubo per alcuni, un gioco da ragazzi per altri. Per la maggior parte dei lettori forse un ricordo delle scuole superiori o dell’università, se si sono frequentati corsi scientifici. Di cosa si tratta? Perché è stata “inventata” l’ ossidoriduzione? Non per torturarci ma per codificare alcuni processi fisici e chimici e comprendere meglio ciò che ci accade e che potrebbe accadere. Nella chimica, le ossidoriduzioni sono essenziali.
Ossidoriduzione: di cosa di tratta
In chimica si definiscono così tutte quelle reazioni chimiche in cui cambia il numero di ossidazione degli atomi, ovvero quelle in cui si ha uno scambio di elettroni da una specie chimica ad un’altra. Si può usare anche il termine redox, composto dall’inglese reduction, riduzione e oxidation.
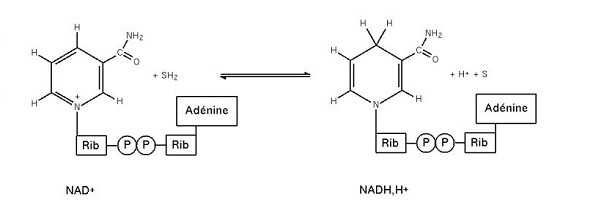
Nella categoria delle ossidoriduzioni troviamo processi semplici come quello dell’ossidazione del carbonio, in cui si genera diossido di carbonio oppure come la riduzione del carbonio dall’idrogeno che produce metano. Ci sono però processi molto più complessi da capire e anche da descrivere come l’ossidazione degli zuccheri nel corpo umano che prevede complicati processi di trasferimento degli elettroni.
Ossidoriduzione: bilanciamento
Ci sono diversi metodi per bilanciare una ossidoriduzione, uno di essi è quello ionico-elettronico che prevede una serie di passaggi relativamente semplici. Si inizia a scrivere i numeri di ossidazione delle specie chimiche per individuare l’ossidante e il riducente per poi dissociare gli elettroliti considerandoli come realmente si trovano in soluzione.
Serve poi bilanciare la valenza dell’elemento aggiungendo elettroni e bilanciare la carica dello ione aggiungendo ioni H+ oppure di OH−, a seconda dell’ambiente in cui ci si trova, se acido o basico. E’ necessario naturalmente bilanciare anche la massa degli idrogeni con l’aggiunta di H2O e moltiplicare le reazioni di ossidazione per il numero di elettroni della riduzione e viceversa.
Abbiamo però due semireazioni che vanno a questo punto sommate facendo il minimo comune multiplo degli elettroni, così possono essere semplificati dal calcolo. Al termine, può essere necessario il bilanciamento degli ossigeni.

Ossidoriduzione: reazioni
Una ossidoriduzione è composta da due semireazioni, una di riduzione e una di ossidazione. Quella di riduzione può essere vista schematicamente così:
specie ossidante + ne− → specie ridotta.
La semireazione di ossidazione invece così:
specie riducente → specie ossidata + ne−.
Con n si intende il numero di elettroni scambiati durante la reazione, deve essere uguale in entrambe le semireazioni. Dalle due semireazioni si ha la reazione di ossidoriduzione rappresentata come:
specie ossidante + specie riducente → specie ossidata + specie ridotta
Ossidoriduzione: esercizi
Per effettuare gli esercizi sulle ossidoriduzioni è meglio considerare le due distinte “semireazioni” e pensare a come avvengono. Nell’ossidazione aumenta il numero di ossidazione di una specie chimica per via della cessione di elettroni da parte della specie considerata. Nella riduzione si ha una diminuzione del numero di ossidazione di una specie chimica a causa dell’acquisizione di elettroni da parte della specie.

Ossidoriduzioni via chimica
Ci sono due modi, principalmente, in cui può avvenire una reazione redox. Quando la via percorsa è quella chimica, reagente e ossidante sono messi in contatto diretto e la reazione avviene “in fase omogenea“, cioè in un’unica fase.
Ossidoriduzioni via elettrochimica
La seconda via percorribile è quella “elettrochimica”. In questo caso le due sostanze coinvolte sono separate in due compartimenti e lo scambio di elettroni avviene attraverso un conduttore che collega i due compartimenti. La ossidoriduzione avviene quindi “in fase eterogenea”, ovvero all’interfaccia tra due fasi.
Ossidoriduzione: esempi
La pila di Volta è un esempio di applicazione pratica delle ossidoriduzioni ma troviamo molti altri esempi quando studiamo quasi tutti i processi biochimici essenziali alla vita, a partire dalla respirazione fino quello alla base della produzione di composti chimici come cloro e idrossido di sodio.
Se vi è piaciuto questo articolo continuate a seguirmi anche su Twitter, Facebook, Google+, Instagram
Articoli correlati che possono interessarvi:
