Come è fatto il legame idrogeno, quali sono le sue proprietà e la sua forza. Spiegazione del legame a idrogeno dell’acqua e in altri composti molecolari.
Il legame idrogeno è annoverato tra i cosiddetti “legami deboli”, eppure è grazie alla sua forza che le molecole di acqua riescono ad avere un punto di fusione ed ebollizione così elevato. In questo articolo ti darò una spiegazione semplice ma completa su come è fatto un legame idrogeno e come si forma.
Legame idrogeno: definizione
E’ un legame debole dettato dall’attrazione elettrostatica tra un atomo di idrogeno che porta una parziale carica positiva e un atomo che porta una parziale carica negativa come l’ossigeno, l’azoto, il fosforo o lo zolfo. Nel testo ti riporterò degli esempi pratici per farti capire bene di cosa stiamo parlando. Partirò dal legame a idrogeno per eccellenza, quello dell’acqua.
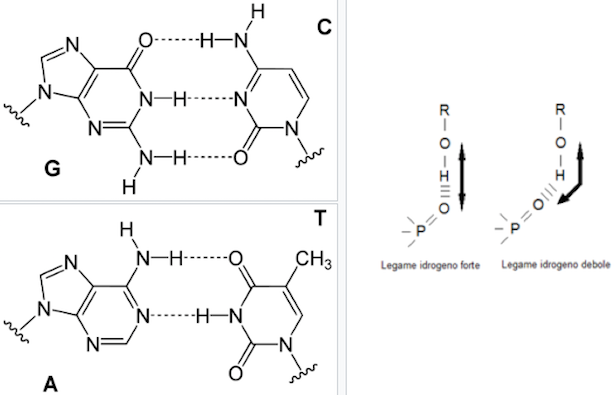
Il legame idrogeno può essere più o meno forte. L’attrazione tra le due cariche elettriche parziali è massima quando gli atomi coinvolti sono posti in line retta. Quando gli atomi che formano un legame a idrogeno fanno parte di una struttura più complessa, non sempre è possibile raggiungere la geometria ideale del legame idrogeno e quindi questo risulterà più debole. Per capire meglio, vedi l’immagine a sinistra della foto in alto.
Legame idrogeno: acqua
I legami idrogeno tra le molecole di acqua rappresentano la forza di coesione in grado di rendere l’acqua liquida a temperatura ambiente, un cristallo solido a zero gradi e un gas a temperature superiori a 100°C. Rispetto agli altri liquidi, l’acqua ha un punto di ebollizione, un calore di evaporazione e un punto di fusione molto elevati e questo è legato proprio alla presenza del legame a idrogeno.
Il legame a idrogeno non deve essere percepito come qualcosa di fisso. Il motivo? In ogni dato momento, la maggior parte delle molecole di acqua è impegnata in legami idrogeno che hanno una vita media che varia da 1 a 20 picosecondi. Quando si rompe un legame a idrogeno se ne forma immediatamente un altro con la stessa molecola o tra molecole vicine.
Il gran numero di legami idrogeno tra le molecole d’acqua conferiscono a questo liquido una grande forza di coesione.
Come è fatto il legame idrogeno dell’acqua?
Nel caso dell’acqua, il legame H-O-H ha un angolo di 104,5°, quasi quanto un tetraedro perfetto (109,5°). Questo schiacciamento è dovuto agli orbitali dell’ossigeno non coinvolti nei legami.
Il nucleo dell’ossigeno attrae gli elettroni in modo molto più forte del nucleo dell’idrogeno. In questo modo si va a creare un dipolo con una distribuzione asimmetrica degli elettroni. Questo dipolo elettrico, nella molecola d’acqua, si esprime con una carica positiva all’estremità degli idrogeni coinvolti e due cariche parziali negative sull’ossigeno.
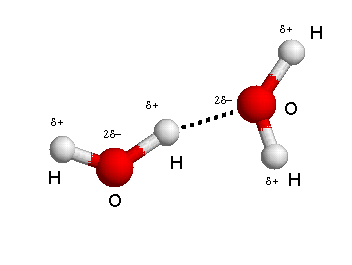
Per capire come è fatto un legame a idrogeno ti basta osservare l’immagine in alto. Il dipolo mostra due cariche parziali positive su ogni idrogeno coinvolto nella molecola d’acqua. In rosso, è mostrato il grosso atomo di ossigeno che porta due cariche parziali negative.
La linea tratteggiata tra l’ossigeno (in rosso) e l’idrogeno della molecola continua (in bianco) rappresenta il legame a idrogeno.
Nell’acqua, il legame a idrogeno è dato dall’attrazione elettrostatica tra l’atomo di ossigeno di una molecola d’acqua e l’atomo di idrogeno della molecola continua.
Il legame idrogeno è più forte quando la carica parziale positiva delle ione idrogeno è posta tra le due cariche parzialmente negative, proprio come avviene nell’acqua (vedi l’immagine dove ogni H+ (con la sua carica parziale positiva) è circondato da due atomi di ossigeno (con cariche parziali negative).
Legame idrogeno: alfa elica delle proteine
Il legame idrogeno ha un ruolo biochimico fondamentale anche nel mantenimento della struttura ad alfa elica delle proteine e la struttura tridimensionale del DNA.
I legami idrogeno sono direzionali e sono capaci di tenere unite due molecole o due gruppi in una direzione molecolare specifica. In questo modo, il legame a idrogeno può determinare strutture tridimensionali ben precise sia nel caso degli acidi nucleici coinvolti nella formazione del DNA sia nel caso dei ripiegamenti dell’alfa elica delle proteine.
La struttura secondaria delle proteine è caratterizzata da legami idrogeno che si formano tra gli NH ammidici e i gruppi carbonilici dello scheletro polipeptidico. Nelle proteine, i tipi di struttura secondaria maggiormente presenti sono: l’alfa elica, il foglietto beta-ripiegato e il ripiegamento-beta.
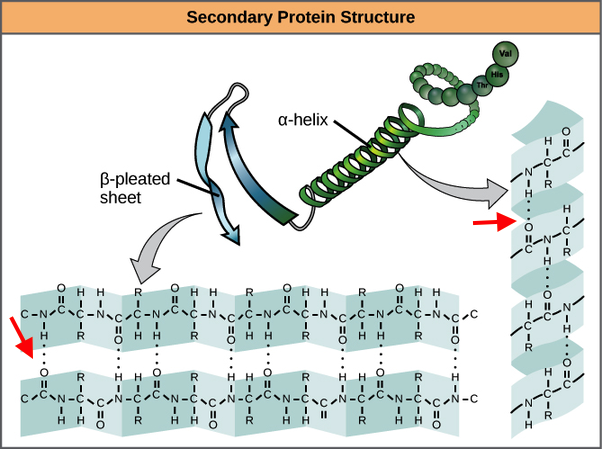
Nell’immagine in alto, con la freccia rossa, abbiamo segnalato i legami a idrogeno che caratterizzano la struttura secondaria delle proteine.
Nel caso dell’alfa elica, la presenza dei legami a idrogeno genera un dipolo elettrico trasmesso lungo tutto il segmento. Il dipolo elettrico di un legame peptidico è dato dai legami idrogeno che si formano tra i costituenti amminici e carbonilici di ogni legame peptidico.
La sequenza amminoacidica influenza la stabilità dell’alfa elica proprio perché non sempre i legami idrogeno si formano su linea retta. Non tutti i polipeptidi, infatti, riescono a garantire alfa eliche stabili.
Legame a idrogeno: doppia elica del DNA
Così come l’alfa elica delle proteine, anche la doppia elica del DNA è stabilizzata dai legami idrogeno che si instaurano tra le basi azotate presenti sui due filamenti. Le basi puriniche formano legami idrogeno con le basi pirimidiniche: A può legare solo T e G può legare solo C. In base alla disposizione geometrica, le basi instaurano tra loro più legami idrogeno: A e T ne formano due, G e C tre.
Nella foto in alto, nota l’immagine a sinistra: ti mostra i legami idrogeno che stabilizzano la doppia elica del DNA formandosi tra le varie basi.
Stai studiando chimica? Se ti è piaciuta la nostra descrizione del legame a idrogeno, prova a leggere le nostre spiegazioni sull’ibridazione del carbonio e gli orbitali molecolari.
