Ibridazione del Carbonio come anche di altri atomi, un fenomeno che ha a che fare con gli orbitali degli atomi e che chi studia chimica o altre materie affini, ben conosce. Vediamo di che si tratta e come mai è oggetto di teoria, approfondimenti ed esercitazioni.
Ibridazione: significato
E’ il meccanismo con cui si combinano matematicamente due o più orbitali atomici per arrivare a ottenere nuovi orbitali, anch’essi atomici, ma che definiamo “ibridi” perché hanno diverse caratteristiche spaziali. Non si fa tutto ciò per puro amore verso la scienza ma perché gli orbitali ibridi ottenuti sono molto più adatti per descrivere la formazione e la struttura delle molecole. Questo non fa che aiutare chi le studia.
Ibridazione del Carbonio
In cosa consiste l’ibridazione del Carbonio? Nel descrivere al meglio la reale configurazione che assumono gli orbitali di questo atomo che è quella che non ci si aspetta, sulla carta. Se prendiamo l’atomo di carbonio, esso ha nel suo stato a più bassa energia ha una configurazione che prevede la presenza di due elettroni nell’orbitale interno 1s, di un orbitale 2s pieno e di due orbitali 2p semipieni.
Poi ci sarebbe un terzo orbitale p vuoto. In tal modo, l’atomo dovrebbe avere la tendenza a stabilire due legami covalenti con altri atomi andando a formare con l’atomo X un legame con angolo di 90° circa. L’atomo di carbonio resterebbe con una coppia di elettroni di non legame 2s e un orbitale p vuoto.
Nella maggioranza dei casi invece accade che l’atomo di Carbonio nei suoi composti vada a formare 4 legami e con angoli di legame diversi da quelli prevedibili in base alle distribuzioni di carica dei suddetti orbitali atomici.
Inizialmente è parsa una contraddizione ma con un approccio più moderno che va a studiare gli orbitali molecolari, è stato meglio compreso che questo atomo, formando legami con altri atomi, modifica i suoi orbitali atomici, rimescolando i 4 elettroni di valenza s e p e riorganizzandoli in tutto o in parte in nuovi orbitali. Sono orbitali ibridi.
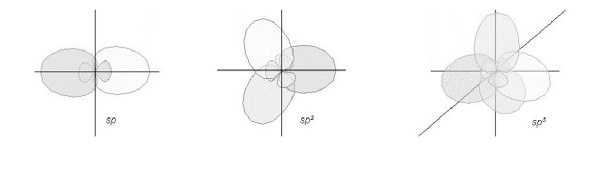
Ibridazione degli orbitali
Come nel caso dell’atomo di Carbonio, la teoria dell’ibridazione serve per spiegare alcune configurazioni che, ragionando in modo “antico” possono sembrare delle improvvisazioni della natura. Ci si trova infatti a volte di fronte a delle molecole di forma tetraedrica, piramidale o piegata planare, oppure di forma trigonale planare, o anche di forma lineare. Con la teoria dell’ibridazione queste apparenti contraddizioni assumono un senso.
Tornando all’atomo di carbonio, possiamo andare a vedere cosa accade quando è nel suo stato ibrido ed è quindi tetravalente. Negli idrocarburi, le ibridazioni servono per descrivere gli atomi di carbonio del metano, (CH4), dell’etene, (C2H4), dell’etino (C2H2). Esistono anche casi di ibridazione più complesse che arrivano a coinvolgere orbitali di tipo d o f e ci restituiscono molecole a geometria trigonale bipiramidale, quadrato-planare, ottaedrica.

Ibridazione DNA
L’ibridazione, nel caso del DNA, è l’appaiamento complementare di due filamenti di DNA oppure di un filamento di DNA e l’altro di RNA. Siamo nel campo della biologia molecolare. Si parla ad esempio di ibridazione DNA-DNA per indicare quella tecnica utilizzata per identificare i batteri. Si va a calcolare quanto DNA dei due organismi si ibrida per arrivare a definire se essi appartengono alla stessa specie (75%), allo stesso genere (25%), o di generi differenti (<7%).
Se vi è piaciuto questo articolo continuate a seguirmi anche su Twitter, Facebook, Google+, Instagram
Articoli correlati che possono interessarvi:
